gestión del riesgo dirigida a profesionales de la salud involucrados en el diagnóstico, tratamiento y seguimiento |Mieloma múltiple |resumen
El mieloma múltiple es un tipo de cáncer que afecta a las células plasmáticas, que son un tipo de células sanguíneas que producen anticuerpos. En el mieloma múltiple, las células plasmáticas anormales se multiplican sin control y forman tumores en la médula ósea, lo que puede interferir con la producción normal de células sanguíneas y causar problemas en el sistema inmunológico.
Los síntomas del mieloma múltiple pueden incluir dolor óseo, fatiga, debilidad, infecciones frecuentes, pérdida de peso y problemas renales. El tratamiento del mieloma múltiple puede incluir quimioterapia, radioterapia, trasplante de células madre y terapias dirigidas a las células plasmáticas anormales.
El mieloma múltiple es una enfermedad crónica que no tiene cura, pero muchos pacientes pueden tener una buena calidad de vida durante muchos años con un tratamiento adecuado y seguimiento médico regular.
Para mejorar el seguimiento de quienes son diagnosticados con MM en Colombia, la Asociación Colombiana de Hematología y Oncología (ACHO) decidió desarrollar el Registro Colombiano de Neoplasias Hematológicas (RENEHOC). En la publicación del 2018 se analizaron 206 personas con MM, con una edad promedio de diagnóstico de 62,9 años. Los síntomas más frecuentes al diagnóstico fueron el dolor óseo (74,2 %), la anemia (58,2 %) y las fracturas patológicas (45,1 %). El tratamiento inicial más común fue el de las combinaciones triples con bortezomib (84 %) y el 40 % de aquellos que fueron tratados con terapia de inducción intensa recibió trasplante autólogo. El grupo presentó una SG del 82 % y el 68 % de la población estuvo libre de progresión.
Epidemiología
La mediana de la edad de diagnóstico del MM es de 67 años (RIC: 69 a 75) y la incidencia aumenta con la edad. Los factores ambientales como la exposición a la radiación ionizante, plaguicidas agrícolas, o productos petroquímicos aumenta el riesgo de presentar MM. Existe una mayor incidencia de MM en quienes tienen artritis reumatoide u obesidad. Sin embargo, no hay un factor de riesgo que predomine en la mayoría de la población con esta enfermedad.
Diagnóstico
Si se sospecha de MM, se requiere un examen físico y neurológico completo, se debe hacer énfasis en las áreas de dolor para detectar fracturas óseas, compresiones de la médula espinal y posibles plasmocitomas.
La enfermedad se diagnostica mediante electroforesis de proteínas en suero u orina o inmunofijación y análisis de aspirado de médula ósea. Las radiografías son importantes para estadificar el MM y revelar lesiones líticas, fracturas por compresión vertebral y osteoporosis. El diagnóstico diferencial de las gammapatías monoclonales incluye la gammapatía monoclonal de significado indeterminado, el MM indolente (MML) (asintomático) y sintomático, la amiloidosis, el linfoma no Hodgkin de células B, la macroglobulinemia de Waldenström y las leucemias raras de células plasmáticas y las enfermedades de cadenas pesadas,
Pronóstico
La inestabilidad cromosómica y las anormalidades citogenéticas que caracterizan al MM, afectan el pronóstico de la persona, por lo tanto, debe considerarse la estadificación del MM, por ejemplo, empleando el Sistema Internacional de Estadificación Revisado (R-ISS, por sus siglas en inglés). Este sistema incorpora factores pronósticos relevantes como β2 microglobulina sérica (Sβ2M), albúmina sérica, recuento de plaquetas, creatinina sérica y la edad. También se considera valorar el riesgo genético evaluado por hibridación fluorescente in situ (FISH, por sus siglas en inglés) y el nivel de lactato deshidrogenasa.
La estadificación del riesgo de una persona determina las opciones terapéuticas y el pronóstico de la enfermedad, así que, para una persona de alto riesgo, la SG generalmente es inferior a los 3 años, aunque se han reportado medianas que oscilan entre los 2 y 10 años; en donde adicionalmente la respuesta al tratamiento es heterogénea.
Tratamiento
A pesar de los avances en el tratamiento farmacológico con diferentes mecanismos de acción (inmunomoduladores, inhibidores de proteasoma, anticuerpos monoclonales), el MM sigue siendo una enfermedad incurable, caracterizada por períodos de remisión y recaída cada vez más cortos.
El TACM es el tratamiento estándar para MM sintomático en menores de 65 años, y para las personas mayores que pueden someterse al tratamiento. Quienes reciben un TACM con dosis altas de quimioterapia de inducción tienen una mediana de supervivencia de 68 meses. Antes del TACM, los protocolos de inducción suelen utilizar vincristina, doxorrubicina y dexametasona o dexametasona y talidomida para evitar la mielosupresión. Aquellos que no son candidatos a un TACM generalmente reciben melfalán y prednisona con o sin talidomida como tratamiento.
El dolor óseo, generado por el compromiso que el MM ocasiona en el hueso, se trata con opiáceos, bifosfonatos, radioterapia, vertebroplastia o cifoplastia y deben evitarse los antiinflamatorios no esteroideos nefrotóxicos. De igual forma, las personas requieren antibióticos de amplio espectro para tratar enfermedades febriles y se debe realizar inmunización contra la gripe, el neumococo y Haemophilus influenzae B, al considerar la susceptibilidad de estas a las infecciones. La hipercalcemia se trata con infusiones salinas isotónicas, esteroides, furosemida o bifosfonatos.
Para profundizar la información se realizó 3 preguntas orientadoras donde se le da respuesta a continuación:
¿Cuál es el proceso diagnóstico en Mieloma Múltiple?
1a. ¿Cuáles son los signos y síntomas de sospecha de Mieloma Múltiple?
Como resultado de la búsqueda y revisión de la evidencia, se identificó una RSL de estudios descriptivos.
La RSL de Ramsenthaler y colaboradores de 2016 tuvo como objetivo establecer la prevalencia de presentación de síntomas en una población con MM. La revisión incluyó 34 estudios en su meta análisis (n=3.023 pacientes), siendo la mayoría estudios de corte transversal (n=19). Las medias de edad de los participantes provenientes de los estudios incluidos se situaron entre los 51 y 71 años, el rango de población masculina fue entre 36,8 y 72 %. Las personas incluidas variaron en cuanto a las etapas de presentación del MM, y no fue posible distinguir subgrupos particulares en los cuales se haya estimado la prevalencia de presentación de signos y síntomas únicamente en aquellas con diagnóstico reciente de MM.
Los principales síntomas reportados fueron la fatiga, la astenia y la adinamia (99 %); seguido por dolor (de predominio lumbar y en costillas, 73 %) y alteraciones gastrointestinales como constipación (65 %) y en menor frecuencia diarrea y vómito (41 %). La esfera mental de esta población también se vio afectada, ya que aproximadamente una de cada cuatro personas con MM cursó con esta alteración; se encontró depresión en el 22 %, alteraciones del sueño en el 35 % y ansiedad en un 36 %. La presentación de dicha sintomatología se relacionó con una importante disminución en las funciones física (99 %) y cognitiva (80 %).
Ante la poca evidencia relacionada con la presentación de signos y síntomas al momento del diagnóstico, el GD consideró analizar la información suministrada por el registro de pacientes de MM de la ACHO referente a la presentación de signos y síntomas en quienes tienen sospecha de MM en Colombia. En esta cohorte de 1.248 pacientes, el dolor óseo fue el síntoma de mayor presentación (74,7 %), seguido por la astenia y la adinamia (49,2 %). Otros signos y síntomas documentados fueron las fracturas (37,1 %), palidez (35,98 %), pérdida de peso (27,32 %), falla renal (24,56 %), infecciones al diagnóstico (7,85 %) y fiebre (7,61 %).
Adicionalmente, la Sociedad Americana de Cáncer ha documentado como signos y síntomas comunes del MM, teniendo en cuenta cómo esta condición afecta a los diferentes órganos y sistemas del cuerpo humano, los que se describen a continuación:
Dolor óseo, más común en la espalda, caderas y cráneo
Debilidad ósea, global (osteoporosis) o local
Fracturas
Anemia, leucopenia y/o trombocitopenia
Deshidratación y polidipsia
Poliuria
Injuria y falla renal
Constipación
Dolor abdominal
Astenia y adinamia
Anorexia
Mareo
Confusión
Parestesias y debilidad muscular, de predominio en miembros inferiores.
1b. ¿Cuáles son los exámenes de diagnóstico que se deben realizar en una persona con sospecha de Mieloma Múltiple?
Para esta pregunta se encontró información en tres GPC. La evidencia se presenta a continuación, de acuerdo con lo reportado en cada GPC y según el examen diagnóstico publicado por los autores de la GPC que soporta la evidencia.
En la GPC Guidelines on the diagnosis, investigation and initial treatment of myeloma: a British Society for Haematology/UK Myeloma Forum Guideline se tuvo en cuenta la evidencia publicada por Kumar de 2016, Dejoied de 2018, Chantry de 2017 y Hillengass de 2019; con base en ello, los autores de la GPC hacen las siguientes recomendaciones:
● Las personas con sospecha de MM deben ser investigados mediante las siguientes pruebas (Recomendación: fuerte. Calidad de la evidencia: baja).
● Pruebas de tamización: hemograma completo, urea y creatinina, calcio, inmunoglobulinas y electroforesis sérica, cadenas livianas libres séricas.
● Pruebas para establecer diagnóstico: aspirado de médula ósea y biopsia de médula ósea con fenotipo ficación de células plasmáticas, inmunofijación en suero, imagenología - PET Scan, escaneo de cuerpo completo por TAC (Tomografía axial computarizada) o RMN (Resonancia magnética nuclear).
● El análisis de cadenas livianas libres séricas debe usarse en vez de la proteína Bence Jones (Recomendación: Fuerte. Calidad de la evidencia: Moderada)
● Se debería usar imagenología transversal e idealmente funcional (PET-CT o RMN corporal total). No se recomienda el uso de análisis esquelético con rayos x para evaluar enfermedad ósea (Recomendación: fuerte. Calidad de la evidencia: moderada)
Guía de práctica clínica: NICE. Myeloma: diagnosis and management. National Collaborating Centre for Cancer.
En la GPC de Myeloma: diagnosis and management. National Collaborating Centre for Cancer. Commissioned by the National Institute for Health and Care Excellence. 2016, se publica información sobre la estrategia óptima de pruebas de laboratorio para la sospecha de mieloma. Los autores de la GPC citan la siguiente evidencia:
Electroforesis de proteínas séricas (EFP; por sus siglas en inglés SPE)
Toman evidencia de cuatro estudios que incluyen 4.888 participantes, que muestran que la electroforesis de proteínas séricas tiene una sensibilidad del 85 % (IC 95 %: 75 % - 92 %) y una especificidad del 95 % (IC 95 %: 85 % - 98 %) para el diagnóstico de trastornos de células plasmáticas.
Análisis de cadenas ligeras libres en suero (por sus siglas en inglés sFLC)
La evidencia de cuatro estudios que incluyó 4.888 personas indica que la proporción de cadenas livianas libres en suero fuera del rango normal tiene una sensibilidad del 47 % (IC 95 %: 33 % - 60 %) y una especificidad del 95 % (IC 95 %: 85 % - 99 %) para el diagnóstico de trastornos de células plasmáticas.
Combinación de SPE y sFLC
La evidencia de tres estudios que incluyó 4.054 participantes muestra que la combinación del análisis de cadenas livianas libres en suero con la electroforesis de proteínas en suero, mejora la sensibilidad para el diagnóstico de los trastornos de células plasmáticas con una estimación conjunta del 94 % (IC 95 %: 72 % - 99 %).
Las personas con una prueba de electroforesis de proteínas séricas negativa pasarían a tener una prueba de cadenas ligeras libres en suero.
Con base en lo anterior, en la GPC se publican las siguientes recomendaciones con una evidencia de alta calidad evaluada por QUADAS-2:
● Utilizar la electroforesis de proteínas en suero y la prueba de las cadenas livianas libres en suero para confirmar la presencia de una paraproteína que indique posible mieloma o gammapatía monoclonal de significado indeterminado (MGUS).
● En personas con electroforesis de proteínas en suero o cadenas livianas libres normales utilice la inmunofijación en suero y en orina de 24 horas para descartar definitivamente MM.
● Para excluir definitivamente el diagnóstico de MM utilice inmunofijación además de electroforesis de proteínas en suero y ensayo de cadenas livianas libres en suero.
● Al realizar un aspirado y una biopsia de médula ósea para confirmar el diagnóstico de mieloma, utilice la morfología para determinar el porcentaje de células plasmáticas y la citometría de flujo para determinar su fenotipo
Guías de práctica clínica: Guía de práctica clínica para el tratamiento del mieloma múltiple.
La guía de práctica clínica colombiana para el tratamiento del mieloma múltiple 2020 presentó un conjunto de recomendaciones basadas en evidencia para el tratamiento del MM activo (sintomático) en adultos mayores de 18 años, ya sean casos nuevos o aquellos en recaída de la enfermedad. En este trabajo se presenta información sobre cuál es la prueba de imágenes diagnósticas (serie ósea completa, TAC corporal de baja dosis, RMN, PET TC que ofrece el mayor rendimiento operativo (sensibilidad y especificidad) para la detección de enfermedad ósea, en un persona con nuevo diagnóstico de MM.
TAC, RMN, PET TC
Se exponen dos RSL de pruebas diagnósticas, el estudio de Regelink y Colaboradores en 2013 y Weng y Colaboradores en 2014. La RSL publicada por Regelink incluyó 32 estudios y concluyó que la RMN, la TCTBD y PET-TC tuvieron una sensibilidad por encima del 90 % (IC 95 %: 66 - 100) en cada una de ellas, cuando la prueba de referencia fue la serie ósea radiológica (SORX). Este estudio permitió concluir que la RMN, el TCTBD y el PET-TC son métodos diagnósticos sensibles con una mayor tasa de detección de enfermedad ósea relacionada con MM en comparación con la SORX. Los autores de la RSL, mencionan que el PET-TC es la única tecnología que puede usarse para hacer seguimiento, ya que permite detectar lesiones metabólicamente activas y, por lo tanto, diferenciarlas de lesiones previamente presentes.
La RSL de Weng y Colaboradores tuvo como objetivo comparar la sensibilidad y especificidad de la RMN y el PET-TC versus la SORX. Cuando se comparó el rendimiento diagnóstico de la RMN versus la SORX, la sensibilidad agrupada de siete estudios fue del 88 % (IC 95 %: 81-93) y especificidad del 68 % (IC 95 %: 61-74). Cuando se comparó el PET-TC versus la SORX, la sensibilidad agrupada de los dos estudios fue del 94 % (IC 95 %: 74-99 %). Los autores de esta RSL concluyeron que la RMN está asociada con una alta sensibilidad, en particular, en la etapa temprana de la enfermedad. El PET-TC estuvo relacionado con una mayor sensibilidad debido a sus características, pues es posible visualizar tanto las lesiones medulares como las extramedulares y de esta manera ser detectadas fácilmente.
Los autores de la GPC recomiendan la realización de RMN (corporal total, de columna total y de pelvis o esquelética) o PET-TC, o TAC corporal total de baja dosis (TCTBD), en comparación con la serie ósea radiológica para la detección de enfermedad ósea en las personas con MM de novo. Esta recomendación es fuerte a favor con calidad de la evidencia: alta.
Los autores de la GPC también detallan los exámenes que se deben tener presentes para el diagnóstico de MM, entre los que se recomienda:
● Detección del componente monoclonal (M) en suero por electroforesis de proteínas; cuantificación de IgG, IgA e IgM por nefelometría; caracterización de cadenas livianas y pesadas por inmunofijación; y cadenas livianas libres en suero. La combinación de la relación de cadenas livianas libres en suero, electroforesis de proteínas en suero e inmunofijación en suero tiene una sensibilidad del 99,5 %.
● No se recomienda realizar estudios en orina, en especial cadenas livianas, ya que la técnica no está estandarizada. Solo se justifica realizar inmunofijación en orina si todos los estudios en suero son negativos, para detectar la pequeña población que es secretora únicamente en orina. Si se confirma la presencia de proteína monoclonal en la orina se recomienda cuantificar mediante proteinuria en 24 horas y electroforesis de proteínas en orina.
● Evaluación de la infiltración en células plasmáticas en médula ósea: el mielograma y la biopsia son el estándar para cuantificar el número de células plasmáticas. Se recomienda realizar siempre estudio completo de médula ósea, teniendo en cuenta que la citometría y el mielograma pueden subestimar el recuento de plasmocitos reales.
● Evaluación de las lesiones líticas en hueso.
● Niveles séricos de calcio, creatinina, hemograma completo.
● Estos estudios permitirán diferenciar una gammapatía monoclonal de significado incierto (MGUS), MM, o MM sintomático.
1c. ¿Cómo se establece el pronóstico en una persona con diagnóstico de MM?
Para esta pregunta se encontró información en tres GPC. La evidencia se presenta a continuación, de acuerdo con las pruebas reportadas por los autores de la GPC que soportó la recomendación.
Guía de Práctica Clínica: Guidelines on the diagnosis, investigation and initial treatment of myeloma.
La GPC Guidelines on the diagnosis, investigation and initial treatment of myeloma: a British Society for Haematology/UK Myeloma Forum Guideline recomienda que se realicen:
Pruebas para estimar la carga del tumor y pronóstico: Análisis FISH para t(4;14), t(14;16), t(11;14), 17p-, 1q+, 1p-, LDH y albúmina. (Recomendación: Fuerte. Calidad de la evidencia: Moderada)
Guías de Práctica Clínica: NICE. Myeloma: diagnosis and management. National Collaborating Centre for Cancer.
En la GPC de Myeloma: diagnosis and management. National Collaborating Centre for Cancer. Commissioned by the National Institute for Health and Care Excellence. 2016, se publica información sobre si las pruebas realizadas en el diagnóstico del MM, incluyendo biopsia de médula ósea, inmunofenotipificación, pruebas citogenéticas y pruebas de genética molecular pueden predecir con exactitud los resultados del tratamiento.
Inmunohistoquímica
Se reportan cinco estudios que investigaron el valor pronóstico de la inmunohistoquímica. La expresión de P53 y la expresión del antígeno ki-67 resultaron ser factores de riesgo independientes para la SG, mientras que la expresión de CD56, CD99 y ciclina D1 no se asoció con la supervivencia.
Citometría de flujo
Se identificaron 14 estudios que investigaron el valor pronóstico de la citometría de flujo. Todos coincidieron en que esta prueba fue capaz de identificar la población con diagnóstico de MM con un mal pronóstico. Cinco estudios concluyeron que las células plasmáticas circulantes clonales eran un factor de riesgo independiente para la supervivencia de las mismas .
Cadenas ligeras libres en suero
Se mencionan ocho estudios que investigaron el valor pronóstico de las cadenas ligeras libres (CLL) en suero. Todos encontraron que las CLL séricas eran pronósticas. Dos estudios informaron que las CLL anormales eran un pronóstico independiente de un mayor riesgo de progresión del mieloma indolente a mieloma activo (66, 67) y cuatro estudios informaron que las CLL anormales eran un factor pronóstico independiente de la supervivencia de las personas con MM. Otros dos estudios también informaron que las CLL séricas eran predictoras de la supervivencia en esta población.
¿Cómo se define y cómo se mide la respuesta al tratamiento en una persona con MM?
Para esta pregunta se encontró información en dos GPC. La evidencia se presenta a continuación, de acuerdo con lo reportado por los autores de la GPC.
Guías de Práctica Clínica: Guía de práctica clínica para el tratamiento del mieloma múltiple.
En la Guía de práctica clínica para el tratamiento del mieloma múltiple se menciona que la evaluación de la respuesta al tratamiento en esta enfermedad es un punto crítico. Se ha demostrado que la profundidad de las respuestas tiene relación con el pronóstico. La GPC destaca el uso de un sistema estandarizado para la evaluación de la respuesta permitiendo la toma de decisiones sobre el tratamiento más efectivo y se cita a Durie y Colaboradores del IMWG (International Myeloma Working Group) que desarrollaron el primer documento con los criterios de respuesta en MM en el año 2006. Los autores resaltan la siguiente información:
Definición de enfermedad medible (cualquier situación):
● Presencia de componente M en suero igual o mayor a 1 gr/dl.
● Presencia de componente M en orina igual o mayor a 200 mg en orina de 24 horas.
● CLL en suero de cadena comprometida igual o mayor a 10 mg/dl, cuando la relación de cadenas kappa/ lambda es anormal.
Si existe enfermedad medible se debe realizar el seguimiento de esta; mediante el mecanismo de detección basal, así:
● En caso de detección de componente M en electroforesis en suero o en orina, se debe utilizar la electroforesis como mecanismo de seguimiento, no se recomienda el uso de medición del componente M por cuantificación de inmunoglobulinas mediante nefelometría y solo debería utilizarse en caso de no disponibilidad de electroforesis de proteínas.
● En caso de no detección de componente M en suero u orina se debe utilizar la prueba de CLL para el seguimiento de la respuesta.
● Solo en caso de no detección de componente M en electroforesis en suero u orina o CLL (MM no secretor) se debe utilizar la medición de la infiltración en médula ósea para evaluar la respuesta. No se recomienda realizar estudios de cadenas livianas en orina.
Periodicidad de la medición de la respuesta:
En las personas que están en tratamiento activo se recomienda la evaluación de la respuesta posterior a cada ciclo de tratamiento, sólo en aquellos que tengan respuesta menor a CR.
● La evaluación de la respuesta en los que tienen respuesta menor a CR no se requiere la realización de CLL.
● El seguimiento de la respuesta con CLL solo se debe realizar en las personas que no presenten componente M por electroforesis de proteínas o en aquellas que presentando componente M tienen normalización de la electroforesis de proteínas en suero y/u orina y la inmunofijación en suero y/u orina.
● No se requieren técnicas radiológicas convencionales (serie ósea o la TAC de baja dosis) para la evaluación de la respuesta.
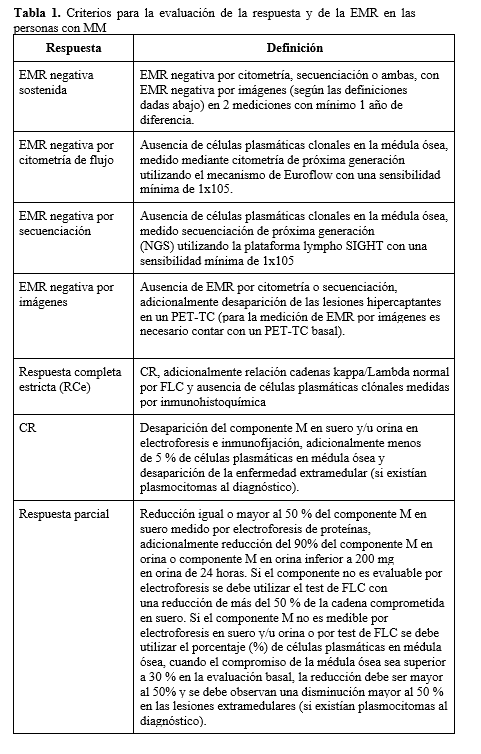
En el 2016, Kumar y Colaboradores del IMWG decidieron actualizar los criterios de 2006, en este se adicionó la medición de la enfermedad mínima residual (EMR) como una herramienta para la evaluación de la respuesta, igual que respuesta completa estricta (REc) y respuesta mínima. En la Tabla 1 se presentan los criterios para la evaluación de la respuesta y de la EMR citados en la GPC.
Para completar la periodicidad de la medición de la respuesta se revisó la información de la GPC: NICE. Myeloma: diagnosis and management. National Collaborating Centre for Cancer. La información se describe a continuación:
Guía de Práctica Clínica: NICE. Myeloma: diagnosis and management. National Collaborating Centre for Cancer.
La GPC de Myeloma: diagnosis and management. National Collaborating Centre for Cancer. Commissioned by the National Institute for Health and Care Excellence. 2016, reporta información sobre el protocolo de seguimiento óptimo para las personas con mieloma, incluyendo la duración, la frecuencia, estudios posteriores y remisión posterior.
Los autores de la GPC publican que no se identificaron estudios sobre protocolos de seguimiento en aquellos con mieloma. Se identificó un estudio observacional que informaba sobre la monitorización/seguimiento de estas después del TACM de primera línea y se identificaron diez estudios que investigaban las pruebas de seguimiento individuales y su precisión en la detección de la enfermedad en el entorno de seguimiento.
El estudio retrospectivo publicó patrones de recaída o progresión de la enfermedad en una población de 273 personas tratadas con terapia de inducción seguida de TACM. Como resultados reportan que la mayoría de estos eventos de enfermedad se asociaron con recaída o progresión de la enfermedad serológica concurrente, donde el 2 % presentó enfermedad clínica sintomática en ausencia de recaída o progresión de la enfermedad serológica. El 85 % tenía recaída o progresión de la enfermedad asintomática, detectada por primera vez por medio de pruebas serológicas, mientras que el 15 % tenía recaída o progresión de la enfermedad sintomática con enfermedad agresiva, recaída o progresión de la enfermedad temprana y corta supervivencia, con una citogenética pobre y una edad más joven identificadas como factores de riesgo. Se encontraron lesiones esqueléticas ocultas en el 40% de quienes son asintomáticos y fueron examinados después de la recaída o progresión de la enfermedad serológica, los estudios óseos anuales y los análisis de orina fueron deficientes a la hora de anunciar la recaída o progresión de la enfermedad.
Se identificaron 10 estudios de precisión diagnóstica. Los estudios incluyen pruebas de laboratorio, la inmunohistoquímica de CD56 y los métodos de imagen, incluyendo WB-MRI (imagen de cuerpo completo por resonancia magnética, en inglés Whole Body- Magnetic Resonance Imaging) WBLD-MDCT (Tomografía computarizada multidetector de cuerpo completo de bajo contraste, en inglés Whole-Body Low-Dose unenhanced MultiDetector Computer Tomography), FDG PET-CT (Tomografía por emisión de positrones con fluorodesoxiglucosa) y TC99MIBI. Los datos indican que las pruebas de laboratorio y la WBLD-MDCT son las más eficaces para detectar la enfermedad en el seguimiento, con la mayor sensibilidad, especificidad y precisión, mientras que la TC99MIBI y la FDG PET-CT parecen ser las menos eficaces.
El GD de la GPC se basó en su experiencia clínica para redactar las siguientes recomendaciones, debido a la poca evidencia hallada:
● Monitorizar a quienes tengan mieloma indolente cada 3 meses durante los primeros 5 años y decidir la frecuencia de los controles posteriores en función de la estabilidad a largo plazo de la enfermedad.
● Monitorizar a las personas que hayan completado el tratamiento del mieloma y se hayan recuperado al menos cada 3 meses. Tenga en cuenta cualquier factor de riesgo de progresión, como:
- FISH de alto riesgo
- Deterioro de la función renal
- Presentación de la enfermedad.
● El seguimiento del mieloma y del MML debe incluir evaluación de:
● Síntomas relacionados con el mieloma y el tratamiento del mieloma, y Pruebas de laboratorio como:
- Recuento sanguíneo completo
- Función renal
- Perfil óseo
- Inmunoglobulinas séricas y electroforesis de proteínas séricas
- Cadenas ligeras libres en suero, si procede.
● No ofrezca a la población con mieloma o MML estudios óseos rutinarios para el seguimiento de la enfermedad.
● Considere la posibilidad de realizar pruebas de imagen dirigidas a los síntomas en el caso de personas con MM o MML si aparecen nuevos síntomas óseos.
● Para aquellas con MM y recaída serológica o progresión de la enfermedad, considere una de las siguientes opciones (teniendo en cuenta las pruebas de imagen anteriores)
- RMN corporal total
- RMN de la columna vertebral
- FDG PET-CT.
● Para aquellos con MML y progresión de la enfermedad, considere una de las siguientes opciones (teniendo en cuenta las pruebas de imagen anteriores)
- TC de cuerpo entero
- RMN de columna vertebral
- FDG PET-CT.
- RMN corporal total o TCTB
La calidad de los estudios de pruebas diagnósticas fue evaluada con QUADAS-2 con bajo riesgo de sesgo en todos los estudios. La certeza de la evidencia se evaluó como baja a moderada debido a que en su mayoría fueron estudios de un solo centro con tamaños de muestra pequeños.
¿Cuáles son los profesionales de la salud que deben participar en el manejo integral de las personas que sufren MM?
Se encontró información para esta pregunta en dos GPC. La evidencia se presenta a continuación, de acuerdo con lo reportado por los autores de la GPC:
Guía de Práctica Clínica: Guidelines on the diagnosis, investigation and initial treatment of myeloma.
La GPC Guidelines on the diagnosis, investigation and initial treatment of myeloma: a British Society for Haematology/UK Myeloma Forum Guideline recomienda que :
Todos los diagnósticos deben ser revisados en reunión de un equipo multidisciplinario (Recomendación: Fuerte. Calidad de la evidencia: Baja).
Guía de Práctica Clínica: NICE. Myeloma: diagnosis and management. National Collaborating Centre for Cancer
En la GPC de Myeloma: diagnosis and management. National Collaborating Centre for Cancer. Commissioned by the National Institute for Health and Care Excellence. 2016, se expone información sobre cuál es la organización óptima de los servicios locales y regionales de hematología para el tratamiento del mieloma (incluido el acceso a la imagen radiológica especializada, los servicios de radioterapia, el tratamiento de la enfermedad renal, la enfermedad de la columna vertebral y la enfermedad ósea, ensayos clínicos, cuidados de apoyo y paliativos).
La GPC indica que no se identificaron estudios en la literatura que examinaran la configuración de los servicios locales y regionales de hematología para el tratamiento del MM. De igual forma, se cita que para obtener orientación sobre las instalaciones necesarias para proporcionar quimioterapia intensiva en régimen de hospitalización y trasplantes a la población con mieloma, así como sobre la estructura y función de los equipos multidisciplinares, la GPC recomienda remitirse a la guía del servicio oncológico del NICE sobre la mejora de los resultados en los cánceres hematológicos.
En ausencia de evidencia, el grupo desarrollador de la GPC se basó en la experiencia clínica y de las personas, así como en el consenso para dar las siguientes recomendaciones:
El equipo multidisciplinario especializado en MM debe contar con apoyo en:
● Servicios de psicología
● Línea de ayuda de hematología para casos agudos las 24 horas del día
● Fisioterapia
● Terapia ocupacional
● Nutrición
● Trabajo social
● Cuidado crítico
● Estructura para que los afectados por la enfermedad participen en ensayos clínicos.
● Servicios de odontología
Adicionalmente, en la red se debe garantizar:
● Quimioterapia intensiva para hospitalización o trasplante
● Nefrología
● Tratamiento de enfermedades de la columna vertebral
● Tratamiento especializado para manejo de dolor
● Aféresis terapéutica
● Radioterapia
● Odontología
Bibliografía
Herramienta Técnica para la gestión del riesgo dirigida a profesionales de la salud involucrados en el diagnóstico, tratamiento y seguimiento de personas con mieloma múltiple. (Septiembre 2022). Instituto de Evaluación Tecnológico en Salud.